Vyhodnotenie cytotoxických, protizápalových a protinádorových účinkov dvoch výživových doplnkov Anosohip a Votalek
Záverečná správa
V súvislosti s implementáciou odseku 2 zmluvy s “UNAVITA”, Macedónskou republikou a Národným centrom infekčných a parazitických chorôb (NCIPD), Bulharsko
Pre štúdiu “Vyhodnotenie cytotoxických, protizápalových a protinádorových účinkov dvoch výživových doplnkov Anosohip a Votalek”
Zrealizovali: doc. Prof. Andrei Tchorbanov; Assos. Prof. Petia Genova-Kalou Ph.D. úvod
Rakovina je jedným z hlavných dôvodov smrti človeka v poslednom desaťročí hneď po kardiovaskulárnych chorobách, infekčných ochoreniach a ischemických srdcových ochoreniach. Súčasné terapie rakoviny zahŕňajú chemoterapiu a rádioterapiu, hoci obe majú vážne vedľajšie účinky. Každý typ rakoviny vyžaduje špecifickú liečbu, čo vysvetľuje potrebu vyvinúť vysoko špecifické protinádorové činidlo [1].
Na liečbu rakoviny sa používajú rôzne imunoterapeutické prístupy. BCG (Bacillus Calmette-Guérin) vakcína proti tuberkulóze, ktorá obsahuje atenuovaný Mycobacterium bovis, je jednou z najrozšírenejších imunoterapeutických látok založených na jeho silných nešpecifických imunostimulačných vlastnostiach [2,3]. BCG sa podáva v prípadoch kolorektálneho karcinómu, karcinómu pľúc a melanómu.
V posledných rokoch bolo schválených množstvo terapeutických protilátok na liečbu rakoviny prsníka (trastuzumab), non-Hodgkinu (Rituximabu) a Hodgkinského lymfómu (Brentuximabvedotín), kolorektálneho karcinómu (Panitumumab, Cetuximab), chronickej lymfocytárnej leukémie (Alemtuzumab) a akútnej myelogénnej leukémie (Gemtuzumabozogamicín) [4]. Imunoterapia cytokínmi je ďalšou možnosťou liečby rakoviny. IL-2 pri metastatickom melanóme a karcinóme obličkových buniek a IFN-alfa pri melanóme III. štádia boli povolené na liečbu rakoviny [5].
Na prevenciu a liečbu malígnych ochorení boli vyvinuté rôzne vakcíny proti rakovine, ale len Sipuleucel-T je schválený na liečbu pokročilého karcinómu prostaty v prípade, že hormonálna liečba je neúčinná [6]. Mnohé vyvinuté vakcíny zahŕňajúkarbohydrátové antigény karcinómu, ktoré sú chemicky konjugované s nosičovým proteínom s alebo bez inej pomocnej látky [7-9].
Dnes sú prírodné produkty a ich zlúčeniny získané z húb, rastlín alebo mikróbov veľmi zaujímavé pre protinádorový výskum. Táto obrovská škála chemických štruktúr poskytuje rôzne mechanizmy a špecifické účinky, ktoré sa používajú pri protinádorovej terapii. Množstvo prírodných zlúčenín je navrhnutých na reparáciu, stimuláciu alebo zlepšenie reakcií imunitného systému. Väčšinou ide o malé molekuly, inhibítory kľúčových enzýmov pre karcinogenézu ako matricové metaloproteinázy (MMP), HIF, topoizomerázu, proteínovú kinázu C (PKC) alebo transkripčné faktory ako NFkB [10].
Osobitná pozornosť sa venuje antiangiogenéznym produktom získaným z morí, ktoré potláčajú a zabraňujú tvorbe cievneho systému podporujúceho rast nádorov a inváziu. Väčšina týchto látok pôsobí prostredníctvom inhibície enzýmov alebo faktorov, ktoré sú rozhodujúce pre proces angiogenézy [11].
C-26 myší model kolorektálneho karcinómu je klasický model nádoru, vyvinutý v roku 1975 a určený ako nediferencovaný karcinóm IV. stupňa [40]. Bunky C-26 vykazujú vysokú tumorigenicitu a nízku tendenciu metastázovať hlavne v pľúcach. Inokulované na syngénnych Balb / c myšiach C-26 spôsobujú vysokú mortalitu.
Tento model sa používa viac ako 35 rokov na štúdium procesu karcinogenézy a protinádorovej liečby. Cieľom tejto práce bolo vyvinúť experimentálny myšací model karcinómu hrubého čreva a preskúmať protinádorovú aktivitu novovytvorenej liečby.
Výsledky
Myši
Samičky10 týždňov starých myší Balb / c boli získané od firmy Harlan Farm, Blackthorn, UK. Zvieratá boli držané v podmienkach bez špecifických patogénov (SPF) a manipulácia bola schválená komisiou pre starostlivosť o zvieratá v Ústave mikrobiológie v súlade s medzinárodnými predpismi.
Protilátky
Na experimenty FACS (Fluorescence-activated cell sorting) boli použité FITC (fluoresceín izotiokyanát) –konjugované anti-myšacie CD8 a CD335, PE (Phycoerythrin) konjugované anti-myšacie APC a CD19 a APC (Allophycocyanin) -konjugované anti-myšacie CD4 a CD11bmAbs (eBioscience, Frankfurt, Nemecko).
Bunková línia
Bunková línia C-26 karcinómu hrubého čreva (CT26.WT (ATCC® CRL-2638 TM)) bola kultivovaná v kompletnom médiu RPMI (Medium Roswell Park Memorial Institute) 1640 (Gibco, Gaithersburg, MD) obsahujúci 10% FCS (fetálne teľacie sérum ), 4 mM L-glutamín, 50 uM 2-merkaptoetanol a antibiotiká pri 37 ° C / 5% C02. Konfluentné monovrstvové bunky (90%) boli trypsinizované a použité na vytvorenie pevných nádorov.
Vytvorenie modelu tumoru
Na výber správneho modelu C-26 myšieho karcinómu hrubého čreva boli 2 skupiny myší testované 5 x 105 bunkami na myš. Zvieratá boli pozorované počas 14 týždňov. Hmatateľné pevné nádory sa pozorovali 2 týždne po stimulácii C-26, po ktorom nasledovala 0% prežitie 3 mesiace po aplikácii buniek, čo je prijateľné pre požadovaný model. Skupina myší, ktorým sa podala injekcia iba s PBS, bola použitá ako kontrolná skupina.
Plán liečby
Skupina samíc myší Balb / c (5 zvierat v skupine) bola inokulovaná bunkami C-26 (5×105 buniek / myš) a myši boli kŕmené trikrát denne testovanými látkami (skupina TS). TS obsahuje 0,075 mg Anosohipu 0,2 μl Votaleku na dávku. Kontrolné skupiny myší boli testované bunkami C-26 bez liečby alebo iba PBS (obrázok 1).
Rast nádoru bol monitorovaný meraním hmatateľných pevných nádorov raz týždenne pomocou mikromeradla a bol stanovený objem nádoru. Každé dva týždne bola zvieratám zo všetkých skupín odobratá krv a séra boli zmrazené pri -70 ° C. Všetky experimenty boli opakované.
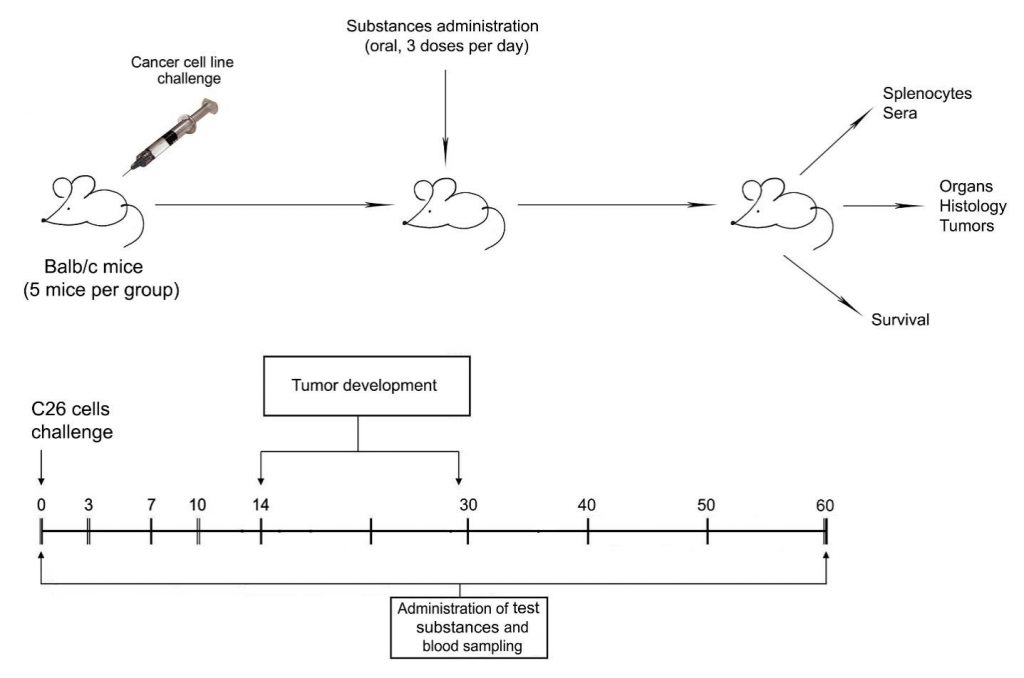 Figure 1. Treatment schedule
Figure 1. Treatment schedule
Fenotyp bunkovej suspenzie sleziny a nádoru
Pri vývoji nádoru sme vykonali analýzu modulácie imunitného systému, keď bol vytvorený model nádoru na demonštráciu imunitnej reakcie na rast nádoru. Orgány myší napadnutých bunkami karcinómu 5 x 105 C-26 alebo iba PBS boli izolované a analyzované prietokovou cytometriou. Boli odobrané sleziny a pevné nádory z reprezentatívneho počtu zvierat (n = 4 až 6) a monokelulárna suspenzia bola izolovaná bunkovým filtrom (BD Biosciences, Erenbodegem, Belguim). Bunky boli premyté PBS (obsahujúcim 2,5% FCS a 0,05% azidu sodného) a inkubované jednou z nasledujúcich anti-myších protilátok anti-CD4-APC, anti-CD8-FITC, anti- CD11bAPC / CD335-FITC alebo CD14-APC. Každý inkubačný krok sa uskutočnil po dobu 30 minút pri 4 °C. Nakoniec boli bunky dvakrát premyté a udržiavané pri 4 ° C. Desať tisíc buniek sa analyzovalo z každej vzorky prietokovým cytometrom BD LSR II s použitím Diva 6.1.1. softvéru (BD Biosciences, San Jose, CA).
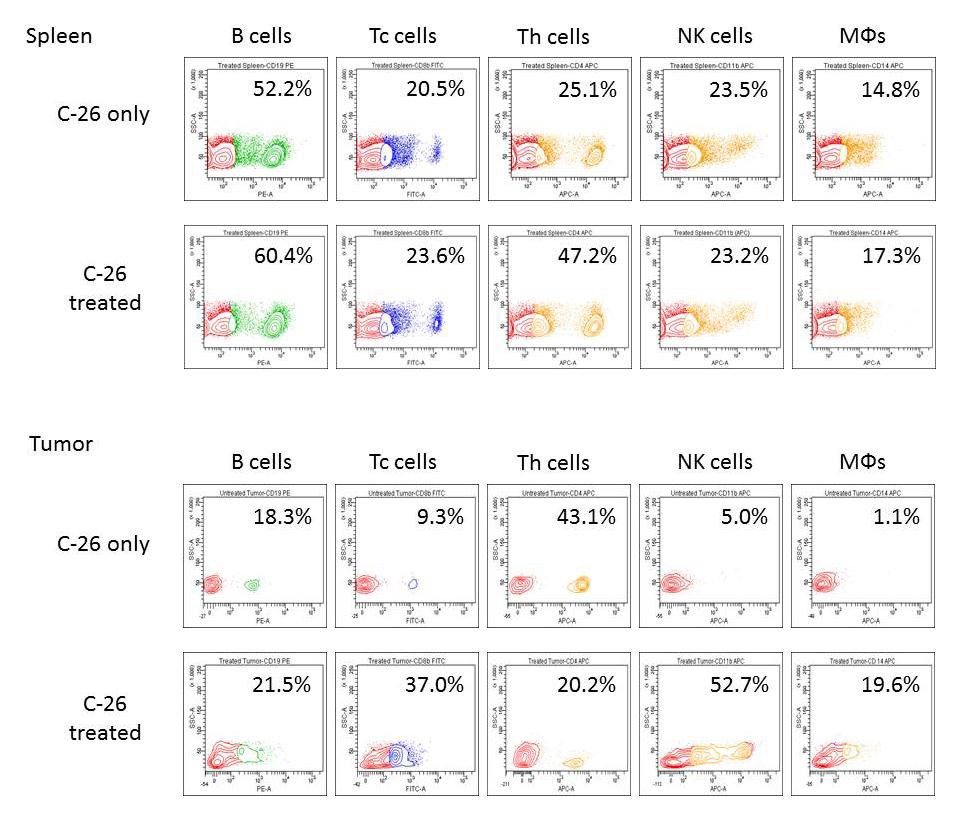 Obrázok 2A.FACS analýza sleziny a nádorových suspenzií. Sleziny (vyššie) a pevné nádory (nižšie) z reprezentatívneho počtu zvierat (n = 4 až 6) boli vyrezané a bunkové suspenzie boli inkubované jednou z nasledujúcich proti-myšacích protilátok – anti- CD4-APC, anti-CD8-FITC, anti-CD19-PE, anti-CD335-FITC / CD11b-APC alebo anti-CD14-APC. Desať tisíc buniek sa analyzovalo z každej vzorky prietokovou cytometriou. Údaje pochádzajú z najmenej 5 experimentov.
Obrázok 2A.FACS analýza sleziny a nádorových suspenzií. Sleziny (vyššie) a pevné nádory (nižšie) z reprezentatívneho počtu zvierat (n = 4 až 6) boli vyrezané a bunkové suspenzie boli inkubované jednou z nasledujúcich proti-myšacích protilátok – anti- CD4-APC, anti-CD8-FITC, anti-CD19-PE, anti-CD335-FITC / CD11b-APC alebo anti-CD14-APC. Desať tisíc buniek sa analyzovalo z každej vzorky prietokovou cytometriou. Údaje pochádzajú z najmenej 5 experimentov.
Pozorovali sme zvýšenie buniek CD4 +, CD8 +, CD19 + a CD14 + v slezinách liečených zvierat v porovnaní s myšími Balb / c injektovanými PBS (obrázok 2A – horné panely). Bunková suspenzia pripravená z pevných nádorov pozorovaných myší ukázala prítomnosť CD4 +, CD8 +, CD19 +, CD335 + / CD11b +, ako aj CD14 + bunkových populácií v nádorovom mikroprostredí (obrázok 2A – spodný panel).
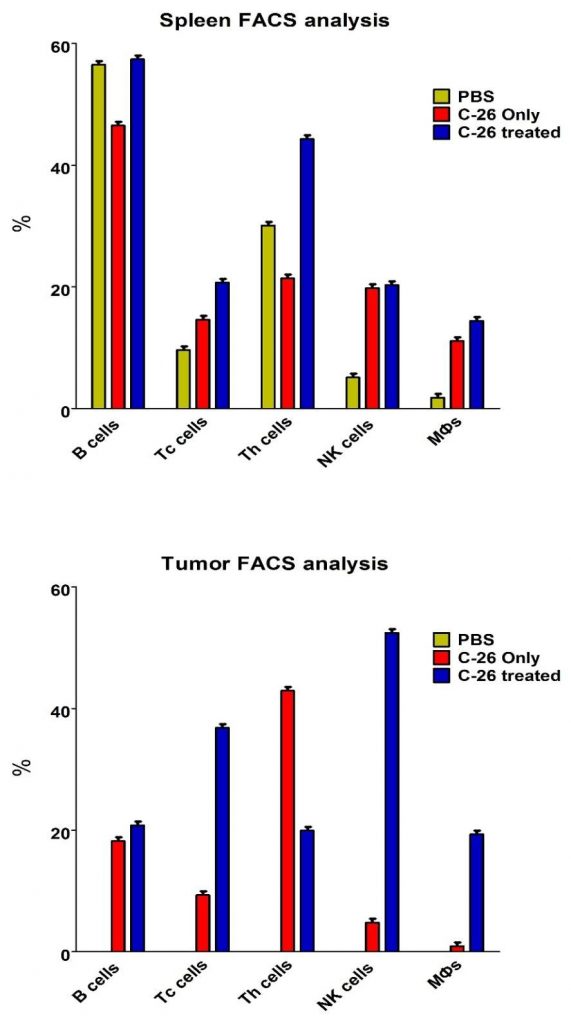 Obrázok 2B. Percentuálny podiel bunkových podtypov z analýzy FACS bunkovej suspenzie sleziny a nádoru.
Obrázok 2B. Percentuálny podiel bunkových podtypov z analýzy FACS bunkovej suspenzie sleziny a nádoru.
Zvýšenie počtu CD8 +, CD19 +, CD335 + / CD11b +, ako aj CD14 + buniek a pokles CD4 + buniek bolo pozorované v liečenej skupine v porovnaní s kontrolnými zvieratami. Tieto výsledky naznačujú pohyb populácií imunitných buniek k rozvinutým nádorom a liečbe (obrázok 2B).
Kvantifikácia cytokínov
Hladiny IFNy, IL10 a IL4 sa merali v myších sérach s použitím súprav ELISA (BD OptEIATM, BD Biosciences Pharmingen, Erenbodegem, Belguim) podľa inštrukcií výrobcu.
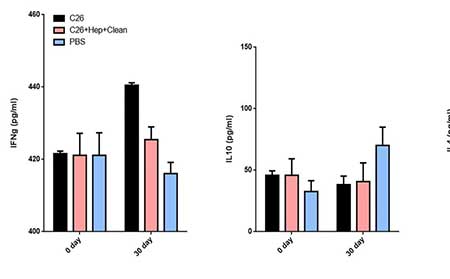
Zaočkovanie 5 x 105 C-26 bunkami karcinómu a liečba PBS spôsobili vysoké hladiny IFNy a IL4 v sére u pokusných zvierat, zatiaľ čo liečba TS znížila hladiny týchto cytokínov (obrázok 3). Avšak podávanie TS neovplyvnilo hladiny IL10 v porovnaní s kontrolnou skupinou.
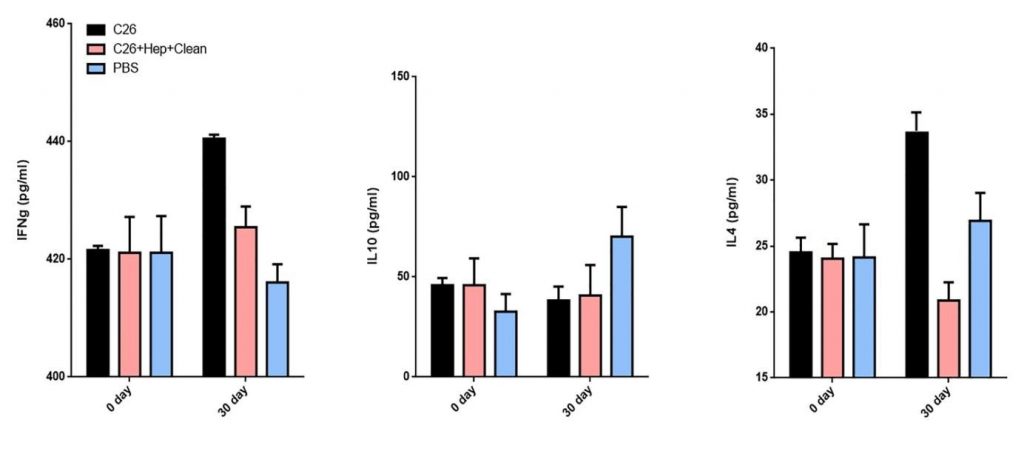 Obrázok 3. Podávanie TS myšiam stimulovaným karcinómom C-26 moduluje produkciu cytokínov. Sérové hladiny IL4, IL10 a IFNy vo všetkých skupinách boli merané sendvičovou ELISA. Všetky vzorky boli vytvorené trojmo a pre analýzu boli použité priemerné hodnoty. Priemerné ± SD hodnoty boli vypočítané pre každú skupinu; Hodnoty p sa vypočítali s použitím obojsmerného testu ANOVA (* p <0,05) v porovnaní s PBS ošetrenými kontrolami.
Obrázok 3. Podávanie TS myšiam stimulovaným karcinómom C-26 moduluje produkciu cytokínov. Sérové hladiny IL4, IL10 a IFNy vo všetkých skupinách boli merané sendvičovou ELISA. Všetky vzorky boli vytvorené trojmo a pre analýzu boli použité priemerné hodnoty. Priemerné ± SD hodnoty boli vypočítané pre každú skupinu; Hodnoty p sa vypočítali s použitím obojsmerného testu ANOVA (* p <0,05) v porovnaní s PBS ošetrenými kontrolami.
Prežitie a prejavy nádoru
Prežitie všetkých testovaných skupín sa porovnávalo s prežitím zvierat očkovanými iba bunkami C-26. Výsledky ukázali 80% prežitie liečenej skupiny v deň 49 v porovnaní s C-26 skupinou bez liečby (obrázok 4A).
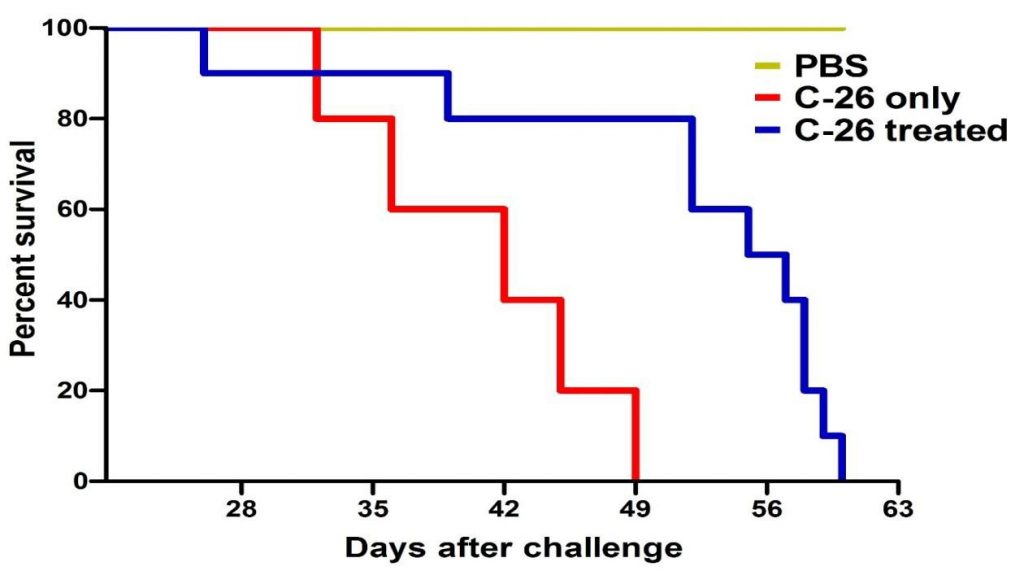
Obrázok 4A. Krivky prežitia sledovaných skupín zvierat. Liečba TS významne predĺžila prežitie myší inokulovaných C-26 (10 zvierat v skupine). Údaje sú uvedené ako priemer ± SD. Hodnoty p sa vypočítajú pomocou Log-rank testu (* p <0,05) v porovnaní s myšami ošetrenými PBS.
Sleziny liečených zvierat boli odobraté a porovnávané s orgánmi z neošetrených chorých myší na rozdiely v rozmeroch.
Dynamika rastu nádoru bola sledovaná u liečenej skupiny v porovnaní s kontrolnou skupinou (iba C-26).
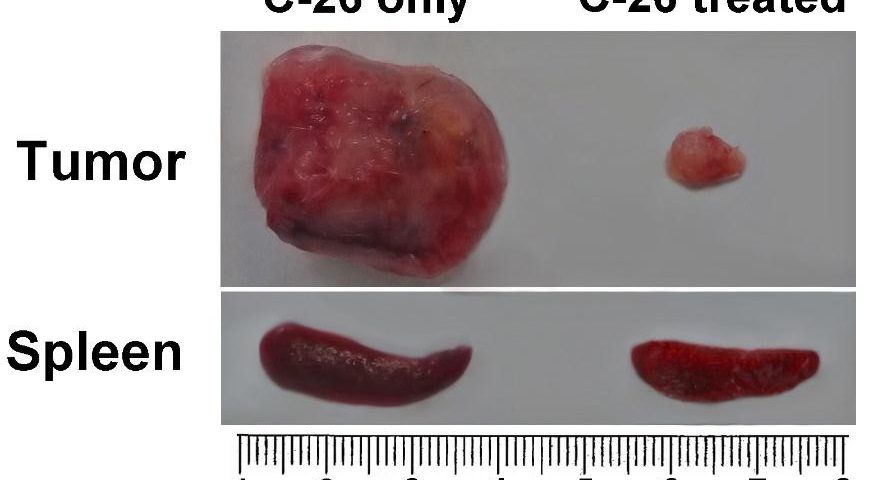
Splenomegália je charakteristickou črtou modelu myšieho nádoru C-26. Myši z každej skupiny boli usmrtené na porovnanie a vyšetrenie orgánov. Pozorovali sme viac ako dvojnásobné zväčšenie sleziny u neliečenej myši nesúcej C-26 v porovnaní s TS zvieratami. Zvieratá liečené s TS vyvinuli nádory malého rozsahu počas celej doby pozorovania (obrázok 4B).
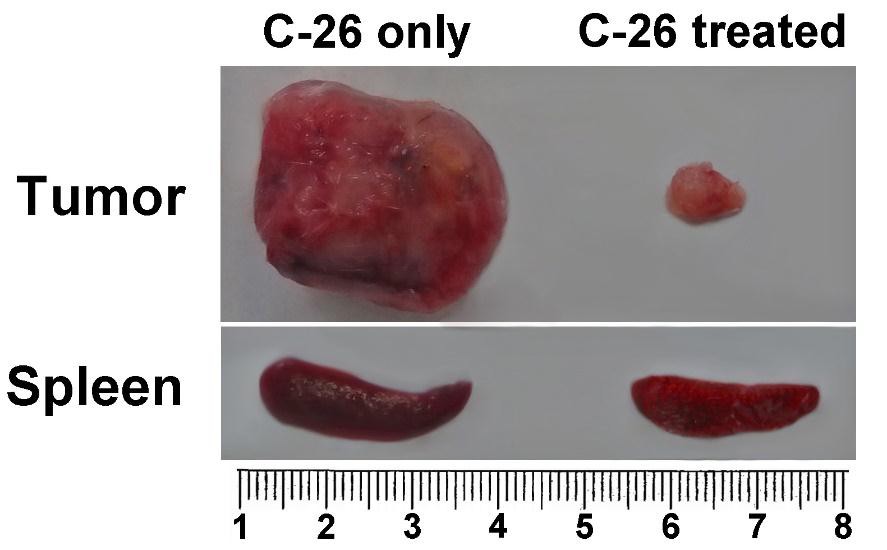
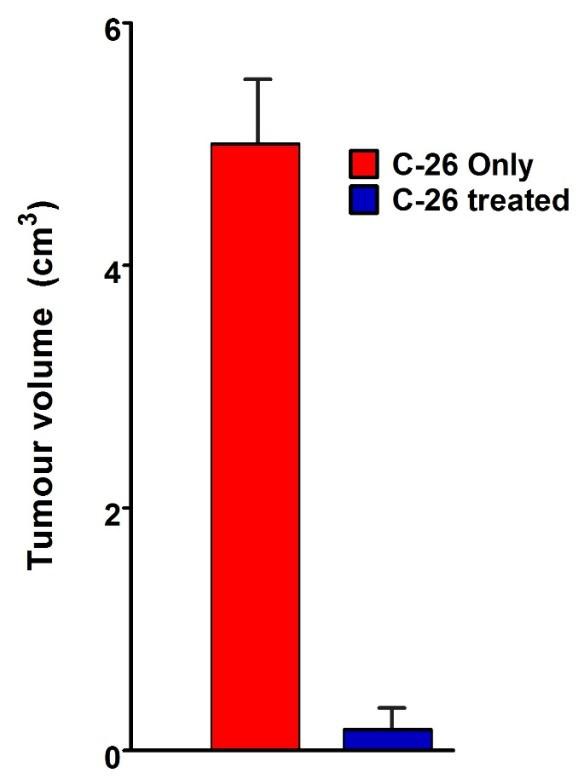
Obrázok 4B. Porovnanie orgánov. Porovnanie sleziny a veľkosti nádorov myší nesúcich C-26 so zvieratami nesúcimi C-26 ošetrovanými TS (horná časť); Dynamika rastu nádorov bola monitorovaná u všetkých zvierat ošetrených TS a porovnávaná s kontrolnou skupinou (len C-26) – obrázok nižšie. Údaje sú uvedené ako priemer ± SD. Hodnoty p sa vypočítajú pomocou obojsmerného testu ANOVA (*** p <0,001) v porovnaní s myšami nesúcimi C-26. Údaje predstavujú aspoň tri nezávislé pokusy.
Histológia a porovnanie orgánov
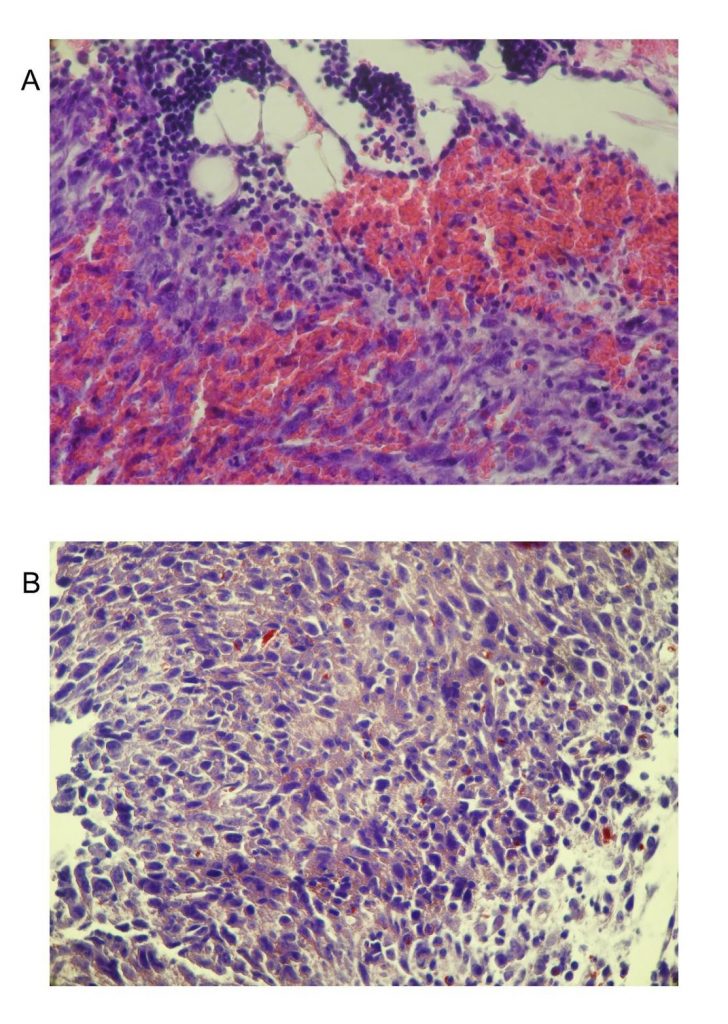
Obrázok 5. Histologické nádorové analýzy. Oblasti obličiek zafarbených hematoxylínom / eozínom z myší nesúcich C-26 (A) a myší nesúcich C-26 ošetreným TS (B). Údaje pochádzajú z 5 experimentov. Pôvodné zväčšenie x 250.
Preskúmali sme morfologické a histologické vlastnosti modelu nádoru C-26. Pevné nádory sa resektovali z umierajúcich zvierat.
Po fixácii vo fosfátovom tlmivom formalíne (10%) sa tkanivá vložili do parafínu a 7μm rezy sa analyzovali použitím štandardnej techniky farbenia hematoxylínom / eozínom.
Parafínové rezy pevných nádorov zo všetkých skúmaných skupín boli zafarbené technikou histologického farbenia heamatoxilin-eozínom a analyzované pomocou svetelného mikroskopu. Tumorová nekróza naznačuje zlú prognózu rôznych typov rakoviny.
Rast nádoru a metastázy závisia od angiogenézy a lymfangiogenézy vyvolanej chemickými signálmi z nádorových buniek vo fáze rýchleho rastu. V neprítomnosti vaskulárnej podpory sa nádory môžu stať nekrotickými alebo dokonca apoptickými. Preto je angiogenéza dôležitým faktorom v progresii rakoviny. Pozorovali sme rozdiely v objeme nádoru u sledovaných zvierat v 6. týždni liečebného plánu. Mikrografy nádorov bez liečby TS ukázali viditeľný proces angiogenézy a prítomnosti erytrocytov v štruktúre nádoru. Toto nebolo pozorované u zvierat liečených TS (obrázok 5). Tieto výsledky by mohli súvisieť s predĺženým prežitím týchto zvierat.
Štatistická analýza
Hodnoty na obrázkoch zodpovedajú priemeru ± SD. Na stanovenie rozdielov medzi každou z dvoch skupín sa použil obojsmerný test ANOVA. Hodnota P <0,05 bola považovaná za štatisticky významnú. Významnosť prežitia bola stanovenápomocou analýzy kriviek prežitia s programom Prism od GraphPad (San Diego, CA).
Odkazy na literatúru:
- Vanneman, M., Dranoff, G. Combining immunotherapy and targeted therapies in cancer treatment. Rev. Cancer. 2012, 12: 237–251
- Morales, A.,Eidinger, D., Bruce, A.Intracavitary Bacillus Calmette-Guerin in the treatment of superficial bladder tumors. Urol. 1976, 116: 180–183.
- Alexandroff, A., Jackson, A., O’Donnell, M., James, K.BCG immunotherapy is used to prevent and treat superficial bladder cancer. BCG immunotherapy of bladder cancer: 20 years on. 1999, 353: 1689–1694.
- Scott, A., Wolcho, J., Old, L.Antibody therapy of cancer. Rev. 2012, 12: 278–287.3893.
- Lee S,Margolin K: Cytokines in Cancer Cancers 2011, 3: 3856–
- Small, , Schellhammer, P., et al. Placebo-Controlled Phase III Trial of Immunologic Therapy with Sipuleucel-T (APC8015) in Patients with Metastatic, Asymptomatic Hormone Refractory Prostate Cancer. J. Clin. Oncol.2006, 24: 3089–3094
- Sabbatini, P., Kudryashov, V., Ragupathi, G., et al. Immunization of ovarian cancer patients with a synthetic Lewisy-protein conjugate vaccine: Clinical and serological Int. J. Cancer 2000, 87: 79–85.
- Ragupathi, G., Slovin, S., Adluri, S., Sames, D., Kim, I.J., Kim, H.M., Spassova, M., Bornmann, W.G., Lloyd, K.O., Scher, H.I., Livingston, P.O., Danishefsky,S.J. A fully synthetic globo H carbohydrate vaccine induces a focused humoral response in prostate cancer patients: A proof of principle. Chem. Int. Ed. Engl. 1999, 38: 563–566.
- Adluri, S., Helling, F., Ogata, S.,Zhang, S., Itzkowitz, S.H., Lloyd, K.O., Livingston, P.O. Immunogenicity of synthetic TF-KLH (keyhole limpet hemocyanin) and sTn-KLH conjugates in colorectal carcinoma patients. Cancer Immunol. Immunother. 1995, 41: 185–192.
- Bhatnagar, I., Kim, S.K. Marine Antitumor Drugs: Status, Shortfalls and Mar. Drugs. 2010, 8: 2702–2720.
- Wang YQ, Miao ZH: Marine-Derived Angiogenesis Inhibitors for Cancer Therapy. Mar.Drugs 2013, 11: 903–933.